
© Eric Boulommie
La conservación de los recursos genéticos de las especies acuáticas amenazadas ha adquirido una importancia creciente en los últimos años. Como resultado de los avances en la ciencia de la crioconservación se ha vuelto bastante fácil congelar esperma de muchas especies acuáticas, pero los óvulos maduros y los embriones en desarrollo son otra historia, al menos en el caso de los peces.
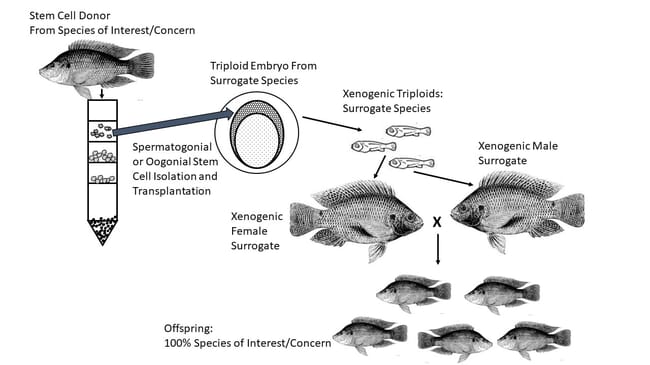
Su tamaño comparativamente grande, su alto contenido vitelino y su limitada permeabilidad de membrana suelen dificultar o imposibilitar su crioconservación, pero en los últimos años se ha demostrado que existe una solución viable. Los tejidos y/o células que acaban desarrollándose en las huevas de pez pueden crioconservarse, descongelarse posteriormente y trasplantarse a peces receptores estériles. Estos receptores sustitutos pueden ser de la misma especie, de especies emparentadas o, en algunos casos, de especies completamente ajenas. Cuando todo funciona, los peces receptores desarrollan gametos masculinos o femeninos funcionales con material genético del donante original. Como resultado, este enfoque ofrece claras ventajas para la conservación de especies amenazadas o en peligro de extinción.
La ciencia (simplificada)
Estas nuevas fronteras en la conservación acuática se centran en el uso de células germinales y células madre gonadales, perfilándose estas últimas como el material de elección cuando se trabaja con peces. Sin entrar en excesivos detalles, las células madre son básicamente células indiferenciadas que pueden multiplicarse en muchas más células del mismo tipo, permanecer latentes o diferenciarse para asumir funciones específicas. Los distintos tejidos y órganos, incluidos los tejidos gonadales de los peces, suelen contener algunas células madre que pueden convertirse en células nuevas y diferenciadas. Para resumir brevemente los orígenes de esos tejidos gonadales, muy pronto en el desarrollo de los embriones de peces pueden distinguirse dos tipos celulares fundamentales: las células germinales y las células somáticas. A medida que las células somáticas comienzan a formar la totalidad del organismo, las células germinales encuentran su camino hacia los tejidos que se convertirán en ovarios o testículos y comienzan a proliferar.
Si las células madre gonadales (o los tejidos espermatogoniales u oogoniales adecuados) de los peces donantes pueden criopreservarse y recuperarse con éxito, pueden introducirse en individuos sustitutos donde funcionarán igual que las células germinales, migrando a la ubicación interna adecuada y desarrollándose en gónadas funcionales (Yoshizaki y Lee 2018). Los peces receptores se hacen estériles de antemano, ya sea mediante la inducción de triploidía o supresión de las células gonadales nativas. Y, en muchos casos, los receptores pueden ser de especies claramente diferentes. Cuando los receptores son de una especie distinta a la del donante, aunque estén estrechamente emparentados, se denominan "xenógenos" Varios resultados de investigaciones recientes confirman que este enfoque representa una nueva y poderosa herramienta para la conservación de los recursos genéticos de varias especies de peces.
¿Funciona realmente?
En 2010, Lacerda et al. informaron sobre los esfuerzos para llevar a cabo el trasplante de células madre espermatogonias en tilapia. Trasplantaron células madre frescas o crioconservadas de una cepa de tilapia a machos previamente esterilizados de otra cepa. Las células madre crioconservadas se convirtieron en espermatozoides en los peces receptores, con una tasa de colonización del 88%. Los machos receptores produjeron finalmente espermatozoides viables y engendraron progenie con el genotipo de la cepa donante.
Ese mismo año, Yoshizaki et al. demostraron que, cuando se trasplantaban a alevines recién eclosionados, las células germinales ováricas de la trucha arco iris acababan diferenciándose en óvulos en las hembras receptoras y en espermatozoides en los machos receptores. Se han descrito resultados similares en otros peces, y esta plasticidad basada en el receptor también podría proporcionar un enfoque alternativo para el cultivo monosex en varias especies.
© Greg Lutz
En 2012 Lee et al. lograron trasplantar espermatagonia previamente congelada en crías triploides de trucha arco iris. Casi la mitad de estos peces pasaron a producir óvulos o espermatozoides funcionales, dependiendo de su sexo fenotípico, que al combinarse dieron lugar a crías normales. Del mismo modo, en 2016, Lee y Yoshizaki demostraron la crioconservación, descongelación y trasplante de células testiculares de la trucha de Manchuria, especie en peligro de extinción, en crías triploides receptoras de la misma especie. Las espermatogonias trasplantadas migraron y se incorporaron al tejido gonadal de los triploides, y algunos receptores desarrollaron testículos maduros, mientras que otros produjeron ovarios maduros. A modo de advertencia, en condiciones reales estos enfoques requerirían varios donantes de células madre para minimizar los impactos de la endogamia, y los xenógenos de un donante sólo se engendrarían con los de otros donantes.
Dando un paso más allá con otro pez en peligro de extinción, Psenicka et al. (2016) utilizaron células y tejido testicular y ovárico en etapa temprana de esturión siberiano para evaluar varios protocolos de manipulación y congelación. Tanto el tejido entero como las células disociadas mostraron una buena supervivencia tras la descongelación. Cuando se trasplantaron a larvas de esturión, al cabo de 90 días habían proliferado en más de la mitad de los receptores. Y ampliando aún más los límites de la distancia filogenética entre donantes y receptores, Silva et al. (2016) trasplantaron con éxito células madre espermatogonias de bagre Jundia (Rhamdia quelen) a tilapia del Nilo macho. Los machos de tilapia se esterilizaron antes del trasplante mediante altas temperaturas e inyecciones de bisulfán. A los 120 días post-procedimiento todos los peces receptores habían comenzado a producir esperma.
La carpa común es una de las especies más cultivadas en aguas continentales y, a lo largo de cientos de años, se ha desarrollado una serie de cepas distintas. Ha surgido la preocupación de que algunas de estas variedades "reliquia" podrían perderse si no se conservan. Trabajando con células oogoniales, Franek et al. (2019) proporcionó una revisión exhaustiva de los procedimientos de criopreservación para preservar los recursos genéticos en esta especie. Curiosamente, las donantes inmaduras que exhiben etapas tempranas de desarrollo ovárico proporcionaron los mejores resultados de criopreservación, probablemente debido a que sus células aún tienen niveles adecuados de permeabilidad de membrana. Yaraş y Çek-Yalniz (2021) también informaron de un mayor éxito al aislar células madre oogoniales de juveniles de trucha marrón, de aproximadamente 15 cm de longitud.
Más recientemente, Ye et al. (2020) desarrollaron un procedimiento para la criopreservación de células madre gonadales de pez espátula americano y esturión de Yangtze. Tras un año en crioconservación, estas células se descongelaron y se trasplantaron a larvas de esturión, donde se incorporaron con éxito. Estos hallazgos, junto con los de Psenicka et al. (2016), son especialmente alentadores si se tiene en cuenta que aproximadamente el 80 por ciento de las especies de esturiones y peces espátula que sobreviven en todo el mundo están consideradas en peligro o en peligro crítico por la Unión Internacional para la Conservación de la Naturaleza.

© Dr Chris Green
Vitrificación por inmersión en aguja
Existen miles de líneas distintas de pez cebra en la investigación biomédica, y cada mes se desarrollan más. Con el objetivo final de una conservación más eficiente del germoplasma de pez cebra, Marinović et al. (2018) presentaron un método viable para la criopreservación de células germinales de pez cebra en etapa temprana utilizando espermatogonias y vitrificación por inmersión en aguja (NIV). En un estudio de seguimiento el grupo presentó más resultados de NIV con altas tasas de éxito. La VNI ofrece algunas ventajas claras a la hora de criopreservar pequeñas muestras de tejido. Los requisitos de crioprotector se reducen porque las muestras de tejido se clavan en una aguja de acupuntura, se colocan en un medio crioprotector y, a continuación, se extraen y se colocan en una solución de vitrificación y, posteriormente, se sumergen directamente en nitrógeno líquido.
Varios de los mismos investigadores de los estudios de Marinović et al. mencionados anteriormente ya habían informado sobre la optimización de protocolos de VNI para tejido ovárico de salmónidos en 2017, concretamente tejido ovárico juvenil de trucha marrón. Y en 2022 parte del mismo grupo de investigación informó sobre el uso de NIV utilizando tejido ovárico en los esturiones Acipenser ruthenus y A. gueldenstaedtii. Las células descongeladas colonizaron con éxito las gónadas de los peces receptores, y los resultados confirmaron la VNI como una herramienta adicional para la conservación de especies de esturión en peligro de extinción.
Acuicultura de producción
Aparte de las iniciativas de conservación, el uso de reproductores sustitutos ofrece una serie de beneficios potenciales para la mejora genética en la acuicultura. Los peces con rasgos superiores o únicos pueden suministrar células para el trasplante a múltiples receptores, mejorando enormemente la producción de crías seleccionadas. También puede ser posible utilizar especies receptoras con intervalos generacionales relativamente cortos para acelerar los programas de selección de especies donantes que necesitan más tiempo para alcanzar la madurez. Y, cuando se desean poblaciones de producción híbridas las tecnologías xenogénicas pueden ofrecer una alternativa práctica al desove artificial a gran escala.
En Estados Unidos, la acuicultura del siluro ha pasado a depender en gran medida de poblaciones híbridas producidas a partir de machos de siluro azul (Ictalurus furcatus) y hembras de siluro de canal (I. punctatus). Estos híbridos ofrecen características superiores en términos de crecimiento, conversión alimenticia y resistencia a las enfermedades. Por desgracia, deben producirse artificialmente en criaderos debido a incompatibilidades de comportamiento que dan lugar a un desove voluntario limitado y poco fiable entre las especies parentales. Además, como los machos de bagre azul no se pueden desovar en tiras, hay que sacrificarlos en el proceso, lo que aumenta considerablemente las necesidades anuales de reproductores machos. Los investigadores de la Universidad de Auburn comenzaron a evaluar el uso de métodos xenogénicos para abordar esta situación hace varios años, y sus progresos han sido impresionantes.

© Dr Chris Green
Perera et al. (2017) publicaron el primer informe de producción xenogénica de híbridos canal x azul, aunque con resultados muy limitados. Trasplantaron espermatogonias de bagre azul en machos triploides de bagre de canal, y dos años más tarde recogieron esperma de uno de estos xenogénicos y lo utilizaron con éxito para fertilizar huevos de bagre de canal, dando lugar a crías híbridas. Poco después, Shang et al. informaron del aislamiento y trasplante con éxito de células germinales testiculares de bagre azul en blástulas de bagre de canal. Los machos xenogénicos de bagre de canal resultantes podrían, en teoría, aparearse de forma natural con las hembras de bagre de canal cada año tras alcanzar la madurez, produciendo descendencia híbrida en cantidades comerciales.
Para 2020, Abualreesh et al. desarrollaron y publicaron un protocolo fiable para congelar espermatogonias de bagre azul, con perfeccionamientos adicionales
en 2021. Al darse cuenta de que disponer de células madre congeladas en depósitos tendría un potencial real para avanzar en la producción a escala comercial de bagres híbridos, los investigadores de Auburn siguieron adelante y en 2022 Hettiarachchi et al. demostraron la producción de xenógenos de bagre de canal utilizando tejidos testiculares y ováricos de bagre azul criopreservados.
Esta investigación continúa en Auburn, con métodos y protocolos que avanzan continuamente, pero también pueden estar surgiendo algunas aplicaciones nuevas. Normalmente no se considera que las huevas de pescado sean un producto especialmente valioso, con la excepción del caviar. Especialmente el caviar de esturión. En 2023, Jacob Al-Armanazi terminó su tesis de máster en Auburn. Uno de los puntos centrales de su investigación consistió en trasplantar células madre oogoniales y espermatogoniales de esturión de lago a siluros híbridos triploides (siluro blanco x siluro azul) y de esturión siberiano a siluro de canal triploide. Casi el 89 por ciento de los bagres híbridos receptores mostraron proliferación de células madre de esturión de lago, y aunque los resultados no fueron tan impresionantes en el caso de los bagres de canal trasplantados, las células madre de esturión siberiano persistieron en casi el 77 por ciento de los receptores.
Células madre de esturión de lago
En resumen, a medida que avanza nuestro conocimiento y dominio de la producción de xenogénesis en peces, pueden producirse una serie de beneficios. La conservación y preservación del germoplasma seguirá siendo una preocupación importante en todo el mundo, para todos aquellos que trabajan con especies de peces amenazadas y en peligro de extinción y también para una serie de sectores dentro de la acuicultura comercial. En los próximos años, la crioconservación y el posterior trasplante de células madre gonadales adquirirán una importancia cada vez mayor en varias especies de peces.







